Nylig publiserte JAMA Oncology (IF 33.012) et viktig forskningsresultat [1] av teamet til Prof. Cai Guo-ring fra Cancer Hospital ved Fudan University og Prof. Wang Jing fra Renji Hospital i Shanghai Jiao Tong University School of Medicine, i samarbeid med KUNYUAN BIOLOGY: “Early Detection of Stra Disectual Stra Disectal Residation III. Kreft via sirkulerende tumor-DNA-metylering og risikostratifisering). Denne studien er den første multisenterstudien i verden som anvender PCR-basert blod-ctDNA multigen-metyleringsteknologi for prediksjon av residiv av kolorektal kreft og residivovervåking, og gir en mer kostnadseffektiv teknisk vei og løsning sammenlignet med eksisterende MRD-deteksjonsteknologimetoder, som forventes å i stor grad forbedre den kliniske bruken av kolorektal kreft-residiv av residivforutsigelse, og signifikant forbedre prediksjon av pasientens liv og overlevelseskvalitet. Studien ble også høyt evaluert av tidsskriftet og dets redaktører, og ble oppført som en viktig anbefalingsartikkel i denne utgaven, og professor Juan Ruiz-Bañobre fra Spania og professor Ajay Goel fra USA ble invitert til å gjennomgå den. Studien ble også rapportert av GenomeWeb, et ledende biomedisinsk medie i USA.

Kolorektal kreft (CRC) er en vanlig ondartet svulst i mage-tarmkanalen i Kina. Data fra 2020 International Agency for Research on Cancer (IARC) viser at 555 000 nye tilfeller i Kina utgjør omtrent 1/3 av verden, med forekomsten på andreplass for vanlige kreftformer i Kina; 286 000 dødsfall utgjør omtrent 1/3 av verden, rangert som den femte vanligste årsaken til kreftdødsfall i Kina. Den femte dødsårsaken i Kina. Det er bemerkelsesverdig at blant de diagnostiserte pasientene er TNM-stadiene I, II, III og IV henholdsvis 18,6 %, 42,5 %, 30,7 % og 8,2 %. Mer enn 80 % av pasientene er i mellom- og senstadiet, og 44 % av dem har samtidige eller heterokroniske fjernmetastaser til lever og lunge, som alvorlig påvirker overlevelsesperioden, setter helsen til våre innbyggere i fare og forårsaker store sosiale og økonomiske belastninger. I følge statistikken til National Cancer Center er den gjennomsnittlige årlige økningen i kostnadene for kolorektal kreftbehandling i Kina omtrent 6,9% til 9,2%, og de personlige helseutgiftene til pasienter innen ett år etter diagnosen kan ta opp 60% av familiens inntekt. Kreftpasienter lider av sykdommen og er også under stort økonomisk press [2].
Nitti prosent av tykktarmskreftlesjonene kan fjernes kirurgisk, og jo tidligere svulsten oppdages, desto høyere er overlevelsesraten på fem år etter radikal kirurgisk reseksjon, men den totale tilbakefallsraten etter radikal reseksjon er fortsatt omtrent 30 %. Fem-års overlevelsesraten for tykktarmskreft i den kinesiske befolkningen er 90,1 %, 72,6 %, 53,8 % og 10,4 % for henholdsvis stadier I, II, III og IV.
Minimal restsykdom (MRD) er en hovedårsak til tilbakefall av tumor etter radikal behandling. De siste årene har MRD-deteksjonsteknologi for solide svulster utviklet seg raskt, og flere tunge observasjons- og intervensjonsstudier har bekreftet at postoperativ MRD-status kan indikere risikoen for postoperativ residiv av kolorektal kreft. ctDNA-testing har fordelene ved å være ikke-invasiv, enkel, rask, med høy prøvetilgjengelighet og overvinne tumorheterogenitet.
De amerikanske NCCN-retningslinjene for tykktarmskreft og de kinesiske CSCO-retningslinjene for tykktarmskreft sier begge at for postoperativ tilbakefallsrisikobestemmelse og valg av adjuvant kjemoterapi ved tykktarmskreft, kan ctDNA-testing gi prognostisk og prediktiv informasjon for å hjelpe til med adjuvante behandlingsbeslutninger for pasienter med stadium II eller III tykktarmskreft. Imidlertid fokuserer de fleste eksisterende studier på ctDNA-mutasjoner basert på high-throughput sekvenseringsteknologi (NGS), som har en kompleks prosess, lang ledetid og høye kostnader [3], med en liten mangel på generaliserbarhet og lav prevalens blant kreftpasienter.
Når det gjelder stadium III kolorektal kreftpasienter, koster NGS-basert ctDNA dynamisk overvåking opptil $10 000 for et enkelt besøk og krever en venteperiode på opptil to uker. Med multigen-metyleringstesten i denne studien, ColonAiQ®, kan pasienter ha dynamisk ctDNA-overvåking til en tidel av prisen og få en rapport på så lite som to dager.
I følge de 560 000 nye tilfellene av tykktarmskreft i Kina hvert år, har kliniske pasienter hovedsakelig med stadium II-III tykktarmskreft (andelen er ca. 70%) mer presserende etterspørsel etter dynamisk overvåking, da når markedsstørrelsen på MRD dynamisk overvåking av tykktarmskreft millioner av mennesker hvert år.
Man kan se at forskningsresultatene har viktig vitenskapelig og praktisk betydning. Gjennom storskala prospektive kliniske studier har det bekreftet at PCR-basert blod ctDNA multigen metyleringsteknologi kan brukes til prediksjon av residiv av kolorektal kreft og residivovervåking med både sensitivitet, aktualitet og kostnadseffektivitet, noe som bedre muliggjør presisjonsmedisin til fordel for flere kreftpasienter. Studien er basert på ColonAiQ®, en multi-gen metyleringstest for tykktarmskreft utviklet av KUNY, hvis kliniske anvendelsesverdi i tidlig screening og diagnose er bekreftet av en sentral klinisk studie.
Gastroenterology (IF33.88), det beste internasjonale tidsskriftet innen gastrointestinale sykdommer i 2021, rapporterte multisenterforskningsresultatene fra Zhongshan Hospital ved Fudan University, Cancer Hospital ved Fudan University og andre autoritative medisinske institusjoner i forbindelse med KUNYAN Biological, som bekreftet den utmerkede ytelsen til ColonAiQ® ved tidlig diagnostisering av kreft og tidlig diagnostisering av kreft, ChangAiQ Den utforsker også den potensielle anvendelsen i prognoseovervåking av tykktarmskreft.
For ytterligere å validere den kliniske anvendelsen av ctDNA-metylering i risikostratifisering, veiledende behandlingsbeslutninger og tidlig tilbakefallsovervåking i stadium I-III kolorektal kreft, inkluderte forskerteamet 299 pasienter med stadium I-III kolorektal kreft som gjennomgikk radikal kirurgi og tok blodprøver ved hvert oppfølgingspunkt (tre måneders mellomrom) innen én uke etter operasjon, og etter operasjonen, i løpet av en uke før, og etter operasjonen. blod ctDNA-testing.
For det første ble det funnet at ctDNA-testing kunne forutsi risikoen for residiv hos kolorektal kreftpasienter tidlig, både preoperativt og tidlig postoperativt. Preoperative ctDNA-positive pasienter hadde høyere sannsynlighet for postoperativt residiv enn preoperative ctDNA-negative pasienter (22,0 % > 4,7 %). Tidlig postoperativ ctDNA-testing predikerte fortsatt residivrisiko: en måned etter radikal reseksjon hadde ctDNA-positive pasienter 17,5 ganger større sannsynlighet for å gjenta seg enn negative pasienter; teamet fant også at kombinert ctDNA- og CEA-testing forbedret ytelsen til å oppdage tilbakefall litt (AUC=0,849), men forskjellen var ikke signifikant sammenlignet med ctDNA-testing (AUC=0,839) alene. Forskjellen var ikke signifikant sammenlignet med ctDNA alene (AUC=0,839).
Klinisk stadieinndeling kombinert med risikofaktorer er i dag hovedgrunnlaget for risikostratifisering av kreftpasienter, og i dagens paradigme går fortsatt et stort antall pasienter tilbake [4], og det er et presserende behov for bedre stratifiseringsverktøy da over- og underbehandling eksisterer side om side i klinikken. Basert på dette klassifiserte teamet pasienter med stadium III kolorektal kreft i ulike undergrupper basert på klinisk residivvurdering (høy risiko (T4/N2) og lav risiko (T1-3N1)) og adjuvant behandlingsperiode (3/6 måneder). Analysen fant at pasienter i høyrisiko-undergruppen av ctDNA-positive pasienter hadde en lavere residivrate dersom de fikk seks måneders adjuvant behandling; i lavrisiko-undergruppen av ctDNA-positive pasienter var det ingen signifikant forskjell mellom adjuvant behandlingssyklus og pasientresultater; mens ctDNA-negative pasienter hadde en signifikant bedre prognose enn ctDNA-positive pasienter og en lengre postoperativ residivfri periode (RFS); stadium I og lavrisiko stadium II kolorektal kreft Alle ctDNA-negative pasienter hadde ingen tilbakefall innen to år; derfor forventes integrering av ctDNA med kliniske funksjoner å optimalisere risikostratifisering ytterligere og bedre forutsi tilbakefall.
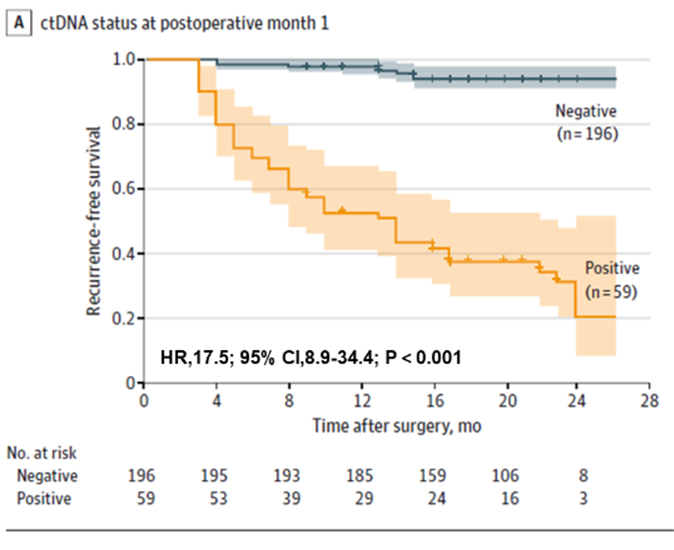
Figur 1. Plasma ctDNA-analyse ved POM1 for tidlig påvisning av residiv av kolorektal kreft
Ytterligere resultater av dynamisk ctDNA-testing viste at risikoen for tilbakefall var signifikant høyere hos pasienter med positiv dynamisk ctDNA-testing enn hos pasienter med negativ ctDNA under overvåkingsfasen av sykdomsresidiv etter definitiv behandling (etter radikal kirurgi + adjuvant terapi) (Figur 3ACD), og at ctDNA kan indikere enn bildediagnostikk opp til 3 måneders tilbakefall (BFigur tidligere), muligheten for tidlig oppdagelse av tilbakefall av sykdom og rettidig intervensjon.
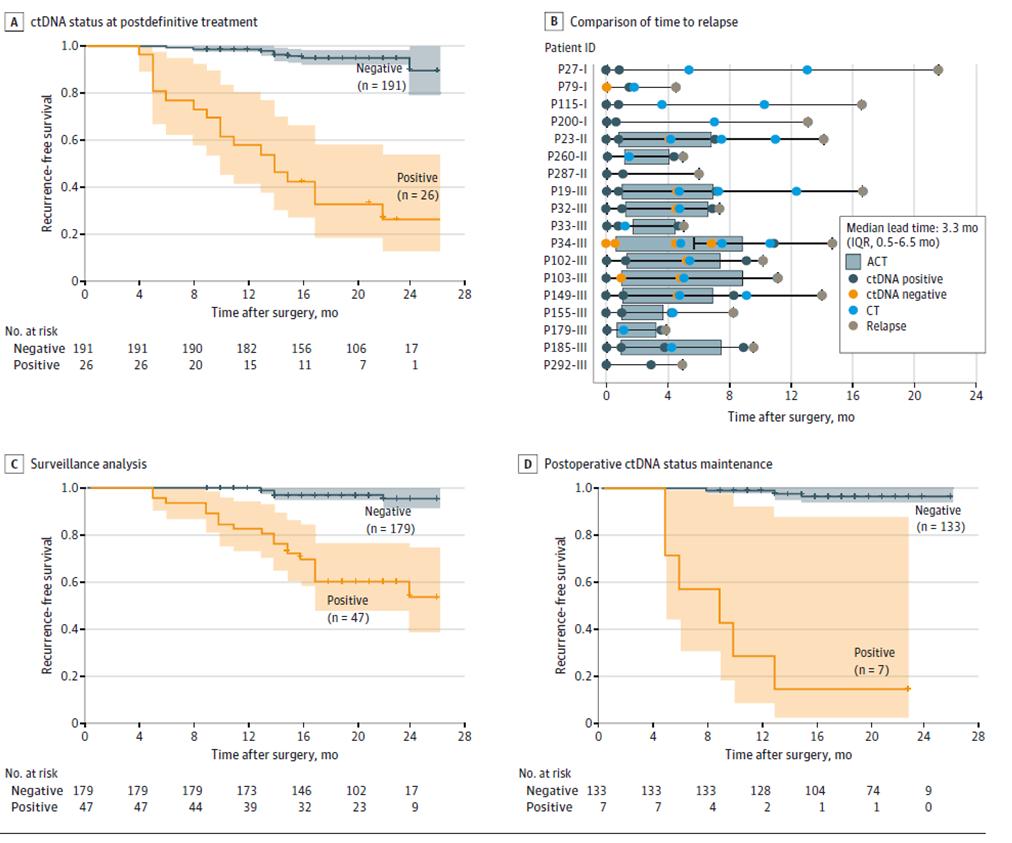
Figur 2. ctDNA-analyse basert på langsgående kohort for å oppdage residiv av kolorektal kreft
"Et stort antall translasjonsmedisinske studier innen kolorektal kreft leder faget, spesielt ctDNA-basert MRD-testing viser et stort potensial for å forbedre postoperativ behandling av kolorektal kreftpasienter ved å muliggjøre stratifisering av residivrisiko, veilede behandlingsbeslutninger og tidlig overvåking av residiv.
Fordelen med å velge DNA-metylering som en ny MRD-markør fremfor mutasjonsdeteksjon er at den ikke krever helgenomsekvenseringsscreening av tumorvev, brukes direkte til blodprøver og unngår falske positive resultater på grunn av påvisning av somatiske mutasjoner som stammer fra normalt vev, godartede sykdommer og klonal hematopoiesis.
Denne studien og andre relaterte studier bekrefter at ctDNA-basert MRD-testing er den viktigste uavhengige risikofaktoren for tilbakefall av stadium I-III kolorektal kreft og kan brukes til å veilede behandlingsbeslutninger, inkludert "eskalering" og "nedgradering" av adjuvant terapi MRD er den viktigste uavhengige risikofaktoren for tilbakefall etter kirurgi for stadium I-III kolorektal kreft.
Feltet MRD utvikler seg raskt med en rekke innovative, svært sensitive og spesifikke analyser basert på epigenetikk (DNA-metylering og fragmentomikk) og genomikk (ultra-dyp målrettet sekvensering eller helgenomsekvensering). Vi forventer at ColonAiQ® fortsetter å organisere kliniske studier i stor skala og kan bli en ny indikator på MRD-testing som kombinerer tilgjengelighet, høy ytelse og rimelig og kan brukes mye i rutinemessig klinisk praksis."
Referanser
[1] Mo S, Ye L, Wang D, Han L, Zhou S, Wang H, Dai W, Wang Y, Luo W, Wang R, Xu Y, Cai S, Liu R, Wang Z, Cai G. Early Detection of Molecular Residual Disease and Risk Stratification for Stage I to III Colorectal Cancer via M Circulating. JAMA Oncol. 20. april 2023.
[2] “Byrden av tykktarmskreftsykdom i den kinesiske befolkningen: har den endret seg de siste årene? , Chinese Journal of Epidemiology, Vol. 41, nr. 10, oktober 2020.
[3] Tarazona N, Gimeno-Valiente F, Gambardella V, et al. Målrettet neste generasjons sekvensering av sirkulerende tumor-DNA for sporing av minimal gjenværende sykdom i lokalisert tykktarmskreft. Ann Oncol. 1. november 2019;30(11):1804-1812.
[4] Taieb J, André T, Auclin E. Raffinering av adjuvant terapi for ikke-metastatisk tykktarmskreft, nye standarder og perspektiver. Kreftbehandling Rev. 2019;75:1-11.
Innleggstid: 28. april 2023
 中文网站
中文网站